Identifikátor zdravotnického prostředku (Unique Device Identifier, UDI) přináší do zdravotnického průmyslu mnoho výhod. Na druhou stranu s sebou nese řadu výzev pro výrobce a dovozce zdravotnických prostředků. Ti se při implementaci UDI setkávají s různými aspekty, které vyžadují čas, odbornou přípravu a pečlivé vyhodnocení.
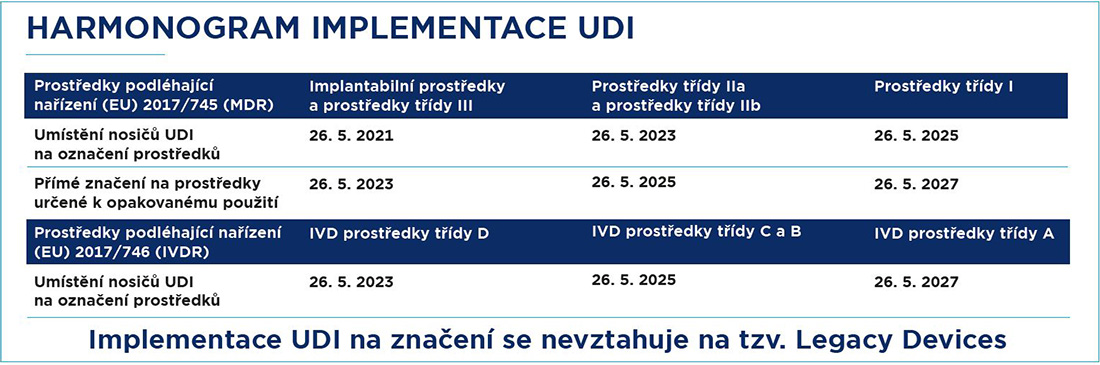
Klíčovým legislativním dokumentem v oblasti zdravotnických prostředků je nařízení (EU) 2017/745. Tento dokument, známý také jako nařízení o zdravotnických prostředcích (Medical Device Regulation, MDR), představuje modernizovaný rámec pro regulaci zdravotnických prostředků v EU. MDR stanovuje povinnost označovat výrobky definované jako zdravotnické prostředky identifikátorem UDI a tím zajistit jejich sledovatelnost napříč celým dodavatelsko-odběratelským řetězcem. Legislativa současně nařizuje obligatorní zaznamenávání kmenových dat ke zdravotnickým prostředkům. V Evropě bude tuto roli plnit EUDAMED (ve Spojených státech databáze GUDID).
Jednoznačná identifikace zdravotnických prostředků UDI má za cíl podpořit bezpečnost pacienta. Systém UDI představuje efektivní nástroj pro správu kmenových dat, ověření původu a vysledovatelnost všech produktů. Systém se může zdát na první pohled složitý, ale není tomu tak. GS1 Czech Republic je s vámi a poskytne při implementaci plnou podporu. Jaké otázky nám kladete nejčastěji?
Máte ještě čas?
MDR určuje závazné termíny zavedení systému UDI podle kategorie a vlastností zdravotnického prostředku rozdělených do čtyř tříd. Je velmi výhodné tuto problematiku řešit včas. Tento proaktivní přístup doporučujeme: jde o novinky, jejichž aplikace v zajetém výrobním nebo dodavatelském procesu mohou vyžadovat více času.